防护服怎么出口?下面看看海关怎么说:
一
商品归类:
除特殊情况外,绝大部分防护服按照材质分类应归入下列税号:
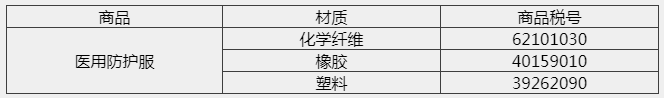
二
禁限管理:
目前商务部未对防护服设置贸易管制要求,中国海关也无针对防护服物资的监管证件口岸验核要求。
三
出口退税:
防护服的出口退税率为13%。
四
原产地优惠:
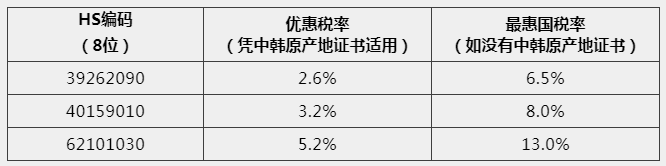
中国已经和25个国家或地区签署了17个自由贸易协定,中国原产的商品,包括疫情防控物资,出口到这些国家和地区凭优惠原产地证书可以获得关税减免优惠。
以出口防护服到韩国为例,可以看到关税减免的幅度是很大的,所以建议出口前向海关申请原产地证书。
五
产品准入条件:
美国
必须要取得美国食品和药物管理局fda注册认证才可以在美国本土市场进行销售。

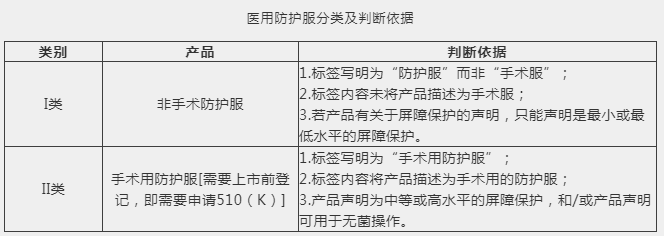
防护服分类:
美国医用防护服可分为非手术防护服和手术用防护服两类。非手术防护服属于i类医疗器械,免于上市前登记,直接进行机构注册。而手术用防护服属于ii类医疗器械,需要进行上市前登记,即需要申请fda 510(k)。i类和ii类医用防护服的判断依据见下表。
2004年,fda认可了美国国家标准学会/美国医疗器械促进协会标准ansi/aami pb70《医疗保健设施中使用的防护服和防护布的液体阻挡层性能和分类》。企业申请上市前登记,一般都需要根据ansi/aami pb70对防护服进行性能测试。
欧盟
须获得欧盟ce认证,并符合技术法规:(eu)2016/425
2016年3月9日,欧盟通过了个人防护装备(ppe)法规(eu) 2016/425,该法规撤销并替代了ppe指令89/686/eec,于2018年4月21日正式实施,并指出2019年4月21日之后投放市场的产品必须满足(eu)2016/425中所有的要求,该法规覆盖防护服、呼吸防护设备、手套等防护产品的安全监管。此期限,出口外贸企业和生产企业须重点注意。
根据法规(eu)2016/425第8条,出口欧盟的防护服制造商需要:
● 确保其产品符合法规附件ⅱ列出的基本健康及安全要求;
● 撰写法规附件ⅲ所述的技术文件;
● 进行适用的合规评估程序;
● 撰写欧盟合规声明;
● 按照法规在产品贴附ce标记;
● 在个人保护装备标明制造商的名称、注册商号或注册商标、地址等;
● 确保个人保护装备附有类型、批次或序列编号,以便识别;
● 撰写使用说明,与个人防护装备一并提供。说明书必须包含制造商的名称及地址,以及可以连接到欧盟合规声明的互联网址。若欧盟合规声明是随个人防护装备附上,说明书则无需包含互联网址。
个人防护装备投放市场后10年内,制造商必须保存其技术文件及欧盟合规声明。
法规原文网址:

日本
如果需要投放市场产品必须满足日本的pharmaceutical and medical device act (pmd act),在pmd act的要求下,toroku注册系统要求国外的制造商必须向pmda注册制造商信息。
日本的政府机构主要是制定法律法规和进行宏观管理,具体业务工作很多都交给各类行业协会来做。防护服涉及的主要行业协会为日本安全设备协会(jsaa)和日本防护服协议会(jpca)。


《防护设备安全认证通知》全文可在
http://www.law.go.kr/행정규칙/보호구안전인증고시下载

澳大利亚
须通过澳洲的tga注册,tga 是therapeutic goods administration的简写,全称是治疗商品管理局。澳大利亚对医疗器械分为i类,is and im, iia, iib, iii类,分别为豁免、备案和注册。无论哪类医疗器械,其上市销售前必须得到澳大利亚政府的准许,符合医疗器械的基本要求,按照符合性审查程序进行审查。
特别提醒:澳大利亚已与欧盟达成互认协议。这意味着,合格评定证书由tga颁发的也被欧盟认可,tga也认可欧盟ce认证。已获ce认证的用户,可提交ce证书及相关资料,获得tga证书。
如果产品已经注册或备案,制造商更换经销商对其没有影响。对国外产品进行注册审批后,每年还要常规注册一次,说明产品型号、性能及质量有无变化。tga 全权负责对医疗器械的符合性评价,并收取一定费用,相关费用金额可参见 tga的网站。

 4000-900-118
4000-900-118

